稳定细胞株作为生物制药CMC的基础工作,一向被重视和瞩目,正所谓“成也萧何,败也萧何”,一个好的细胞株往往能使得后续的工艺开发工作事半功倍,大幅降低抗体/重组蛋白的生产成本;反之则需要花费更多的时间去进行上游工艺的优化和改善,既延长了项目时间,又花费了更多的资金。今天的皓奇星栏目我们便来介绍一下细胞株构建的流程。
CHO细胞历史悠久,并拥有庞大的家族。从1919年,北京协和医学院的Dr. E.T. Hsieh 在北京郊外抓了一些中国仓鼠用作动物模型开始,一直到1948年12月,由美国医生Robert Briggs Watson在协和医学院的Cheng siang-Hu教授的协助下将20只中国仓鼠赶在南京解放前送到上海,并从上海运送到纽约,最后由Victor Schwentker公司驯养成一种实验室动物品系,中国仓鼠一直作为一种实验室研究用动物模型(想到这里笔者痛心疾首,要不是那时中国处于战乱,自己没有能力保存,也不至于今天被ATCC和ECACC掐住脖子)。后Puck成功分离到了中国仓鼠卵巢细胞并体外培养,在接下来的几十年里CHO细胞家族不断壮大,被广泛应用于生物制药领域。
Florian M. Wurm and Maria João Wurm.Cloning of CHO Cells, Productivity and Genetic Stability-A Discussion.
今天不同品系的CHO细胞被用于重组蛋白的表达,其中有代表性的包括:
不同的宿主细胞在细胞株构建中的表现差异很大,本文仅能从笔者有限的经验中提供一些参考,对于初步涉及细胞株工作的朋友,可以采购商品化的宿主细胞试剂盒,并遵照说明书进行操作,熟悉细胞的特性后,再自行优化筛选方式。各种宿主细胞均有各自优劣,使用者需要考虑包括表达水平、蛋白质量、商业授权等各方面因素,例如优势方面,GS系统下表达量和Qp相对较高,DG44系统细胞株稳定性好,K1 筛选周期短且表达量高,CHO-S商业授权清晰;反过来缺点方面GS系统价格昂贵,DG44表达量较低,K1细胞株稳定性较差,CHO-S相对易结团等等。真正有经验的研究人员,则可以根据不同细胞的特性,开发合适的筛选方式和培养工艺,将细胞的潜能挖掘到最大,正如俗语所说“Less is more”,细胞株构建亦然。
生产用稳定细胞株的构建首先由表达载体的构建和细胞转染开始
1、将表达抗体的目的基因构建到载体上,再将该载体转染进入宿主细胞内,常见的转染方式主要有钙转、电转、脂质体转染和逆转录病毒转染,DNA进入宿主细胞核后将会随机整合到宿主细胞基因组当中去,因此表达水平与基因拷贝数、基因整合位点的转录活性有关。
2、接下来不同筛选试剂将被用于筛选能够正确表达目的基因并且高水平表达的细胞群(pool)。
3、由于此时得到的细胞群中的每个细胞特性各异,具有不同的基因整合位点、拷贝数、细胞单产和生长速率,因此需要将其中具有高产、稳定表达特性的细胞个体分离出来分别培养,通常需要获得数百甚至上千的候选克隆供进一步筛选。
4、被筛选出来的克隆经过传代培养和分批补料实验(Fed-batch),比较其生长特性、代谢状况、表达量高低、表达产物质量等,选出最优的几个克隆进入生物反应器放大实验,同步评估细胞株稳定性,最终确定生产用单克隆细胞株。
Soo Min Noh, Seunghyeon Shin and Gyun MinLee. Comprehensive characterization of glutamine synthetase-mediated selectionfor the establishment of recombinant CHO cells producing monoclonal antibodies.
筛选标记
为了有效地筛选出高表达的细胞,表达载体上除了包含抗体的重、轻链以外,往往还含有各种筛选标记,筛选标记一般可以被分为两大类:一类是以G418为代表的抗生素类筛选标记,另一类是以MTX为代表的影响细胞代谢的筛选标记。与此同时,高效的启动子(如CMV)和延长因子(如EF1α)被广泛运用于抗体表达载体。翻译的起始位置是恒定的Kozak序列:GCC GCC(A/C)CC和抗体特异性的信号肽——不同的重轻链类型有各自特异的信号肽序列。
位置效应
插入染色体的位置影响真核基因的表达,即“位置效应”。当外源基因插入异染色质及其附近区域产生位置效应时,此处异染色质区域将产生位置效应斑点,此时,周围的异染色质将有效地阻止插入基因的表达。为了克服“位置效应”,一般有两种办法:1、将目的基因定点整合到合适的位点;2、在目的基因的侧翼加上“绝缘子”DNA序列,从而抑制“位置效应”。
细胞群
当目的基因被转染到宿主细胞内,并按照一定的细胞密度在合适的筛选压力下进行传代培养后便得到了细胞群(pool)。细胞群的表达量取决于转染的方式、筛选压力的作用以及目的基因整合情况 。由于不同的宿主细胞在筛选条件下的特性不同,针对不同的宿主细胞,可以采取不同的细胞群筛选方式,包括是摇瓶中大规模的细胞群的筛选还是孔版中的迷你细胞群的筛选,亦或是选择合适的筛选压力大小,目标是在较短的时间内能够筛选得到表达量相对较高的细胞群。对于不同的项目,在细胞群阶段需要考察的标准不同,对于常规新药抗体,往往表达量会成为第一评价标准;对于生物类似物,则需在细胞群阶段着重考察各项质量参数与原研的差异;对于双特异性抗体,则需要在此阶段就开始考察正确装配的比例,从而降低克隆筛选阶段的风险。
常用的筛选克隆的方法
有限稀释法因为其低成本和易于操作,被广泛运用于克隆的筛选。需要注意的是,为符合FDA的申报要求需进行两轮LDC,且细胞密度<0.5细胞每孔或者一轮LDC结合图像证明,以验证单克隆性。有限稀释法工作量大,往往需要运用自动化工作站进行高通量的筛选。
半固体培养基法进行单克隆的筛选。细胞生长在半固体培养中,形成单克隆细胞团,同时将抗体分泌在细胞团周围,半固体培养基中含有荧光标记的二抗,能与抗体Fc片段特异性结合,当用一定波长的光进行激发时就能发出荧光。使用图像分析软件能够对单克隆细胞团的大小、荧光强度进行测定,从而筛选出生长旺盛、表达量高的单克隆细胞团。自动化的机械臂能够按照实验人员设定的参数将符合要求的细胞团挑取出来用于后续的扩大培养。半固体培养基法能够通过自动化的方式挑取单克隆细胞,大大减轻了实验人员的工作负担,但用于荧光扫描、图像分析和克隆挑取的机器价格昂贵,且为符合申报要求,需要两轮半固体培养基筛选或一轮半固体培养基筛选结合一轮LDC进行。
流式细胞仪分选法(FACS)。将带有荧光标记的二抗和分泌抗体的CHO细胞混合孵育,分泌到细胞表面的抗体就能够被流式细胞仪检测到,从而利用其分选功能筛选出分泌多的细胞。为了使分泌到胞外的抗体能够维持在细胞膜表面,还可以使用微囊将细胞以及分泌的抗体包裹起来。
克隆筛选工作往是微量、高通量,检测和操作手段的改善和升级非常重要,如HTRF(均相时间分辨荧光),可以使用较小的样品量(2.5-5.0μL)进行高通量(384孔板)检测,结合自动化工作站的辅助,能够大幅降低研发人员的工作量。
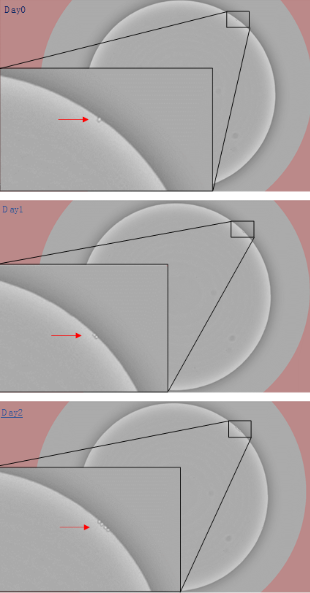
图3.单克隆成像系统下单克隆细胞扩增的过程(使用MD CloneSelect Imager 拍摄)
优秀的单克隆细胞株还要考虑到细胞生长、表达和代谢情况,以及目的蛋白的质量水平。要关注乳酸和氧的代谢,高乳酸和高耗氧可能为细胞株在反应器的培养埋下隐患。细胞株的工艺要考虑到未来反应器中培养的可重复和可放大性,同时选择可及性较强,批次稳定的培养基和补料。培养基的价格跟用量高度相关,根据笔者的经验,年使用量从100L提高到10000L,培养基的单价可以相差5-10倍,大规模使用时,进口商业化培养基的价格一般会处于100-200元/升,而假如拥有自己的CD培养基配方,委托GE、Merck或者Thermo等生产,其价格则会进一步下降到30-100元/升。因此初期大可不用为培养基的单价太过担心,同时在选择好合适的供应商后可以尽早与供应商展开量价谈判,明确大规模使用后的价格。